Technische Dokumentation nach
EU Verordnung MDR 2017/745 (neu)
Letzte Aktualisierung September 2022 V7
Allgemein
Die Vorlage beachtet alle Dokumentationsanforderungen an einen Inverkehrbringer.
Wir haben die MDR Anforderungen detailliert umgesetzt, wie von allen benannten Stellen gefordert.
Wir haben Ihnen viele Vorlagen erstellt zur Umsetzung. Inverkehrbringer von Medizinprodukten müssen entsprechend der Verordnung eine technische Dokumentation erstellen.
Zusätzlich gibt es eine Vorlage "technische Dokumentation nach Inverkehrbringung" nach Anhang III. Dabei ist es unabhängig, ob das Produkt der Klasse :
- I, Im, Ir, Is,
- IIa, IIb oder
- III
zugeordnet wird.
Zielgruppe / Kurzbeschreibung:
Dieses Handbuch ist für Inverkehrbringer von Medizinprodukten. Es beinhaltet Vorlagen um eine CE-Kennzeichnung zu erhalten oder selbst durchzuführen.
Zusätzlich wurden die Vorgaben der MDCG Medical Device Coordination Group eingearbeitet.
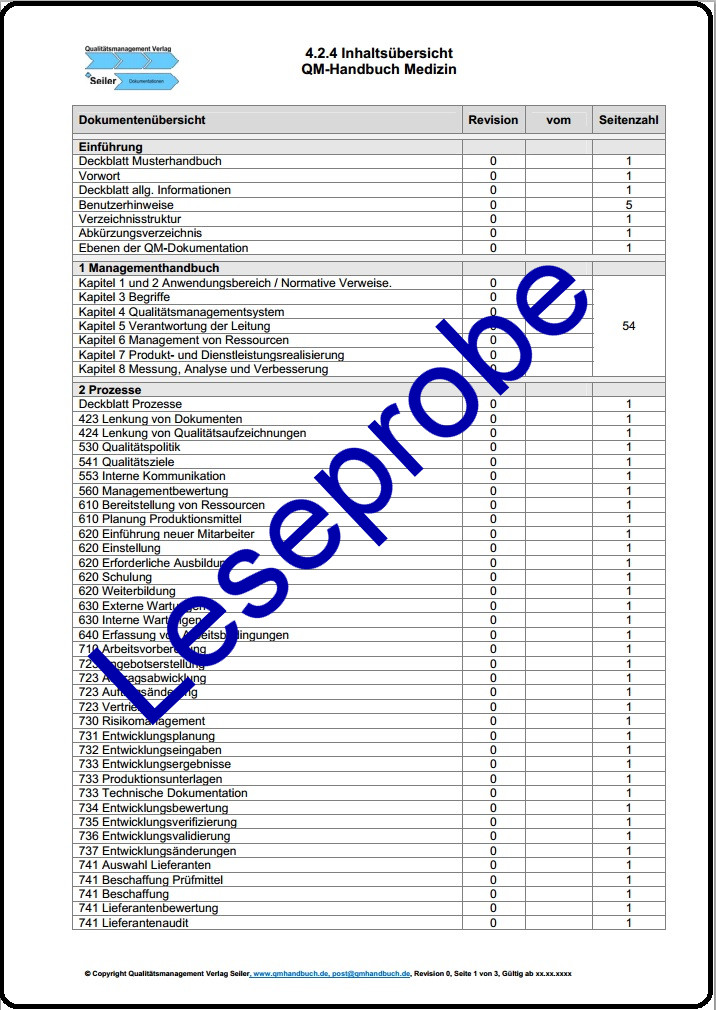
Gliederung Verzeichnisse:
- Technische Dokumentation,
- Prozessbeschreibungen,
- Anweisungen,
- Nachweise und Vorlagen
- Ergänzungen zum QM-System nach DIN EN ISO 13485
Konditionen:
- Keine Ergänzungslieferungen,
- Bezahlung per Rechnung oder PayPal,
- Lieferung per Download oder manuell durch uns
Ihr Vorteil
Mit diesen Vorlagen kann der Zeitaufwand für die Erstellung einer technischen Dokumentation verringert werden. Alle Daten und Vorlagen stehen Ihnen auch in digitaler Form zur Verfügung und können für den unternehmensinternen Gebrauch ohne großen Aufwand verändert werden. Die Erstellung der Produktakte können wir auch als Dienstleistung übernehmen.
Verwandte Produkte:
Besonderes:
Wir haben die Formblätter und Nachweisformen mit Beispielen gefüllt. Dies vereinfacht die Erstellung und Anpassung.
Die Vorlage ist aufgrund der umfassenden Verordnung ebenfalls umfassend.
Wir haben Ihnen viele Bespiele erstellt zur Umsetzung.
Inverkehrbringer von Medizinprodukten müssen entsprechend der Verordnung eine technische Dokumentation erstellen. Zusätzlich gibt es eine technische Dokumentation NACH Inverkehrbringung.
Dabei ist es unabhängig, ob das Produkt der Klasse:
- I, Is, Im, Ir,
- IIa, IIb oder
- III
zugeordnet wird.
ISBN bei Bestellung über den Buchhandel 978-3-947669-00-4
Anzahl Seiten: 337
qualitätsmanagement, mdr, medizinprodukt |
Kein Abo und keine kostenpflichtigen Ergänzungslieferungen!
 |
Alle Vorlagen können in MS-Office Programmen bearbeitet werden. |
| |
Preis: |
|
|
| |
112,00 € inkl. gesetzlicher MwSt.
im Download. |
| |
|
|
|
| |
|
|
|
| |
 |
|

