Musterhandbuch DIN EN ISO 13485:2021-12 - QM mit Beachtung der MDR 2017/745 Anforderungen.
Die derzeit gültige DIN EN ISO 13485:2021 ist zu 100% enthalten. Die DIN EN ISO 13485 und MDR 2017/745 Anforderungen ergeben eine umfassende Vorlage.
Die neue Version der DIN EN ISO 13485:2021 hat als wesentliche Änderung eine Tabelle „ZA“ die zur MDR 2017/745 klarstellt, welche Anforderungen durch die DIN EN ISO 13485 abgedeckt sind.
Wir haben eine Tabelle erstellt die aufzeigt, wie diese Defizite in unserem Handbuch abgedeckt sind. Schauen Sie einfach in der Leseprobe.
Die MDCG Vorgaben sind auf dem aktuellen Stand.
Neu: Um auch eine ISO 9001 Zertifizierung zu erhalten gibt es ein Zusatzverzeichnis.
Zielgruppe:
- • Inverkehrbringer von Medizinprodukten und Einhaltung der MDR 2017/745 Anforderungen an ein QM-System
Gliederung Verzeichnisse:
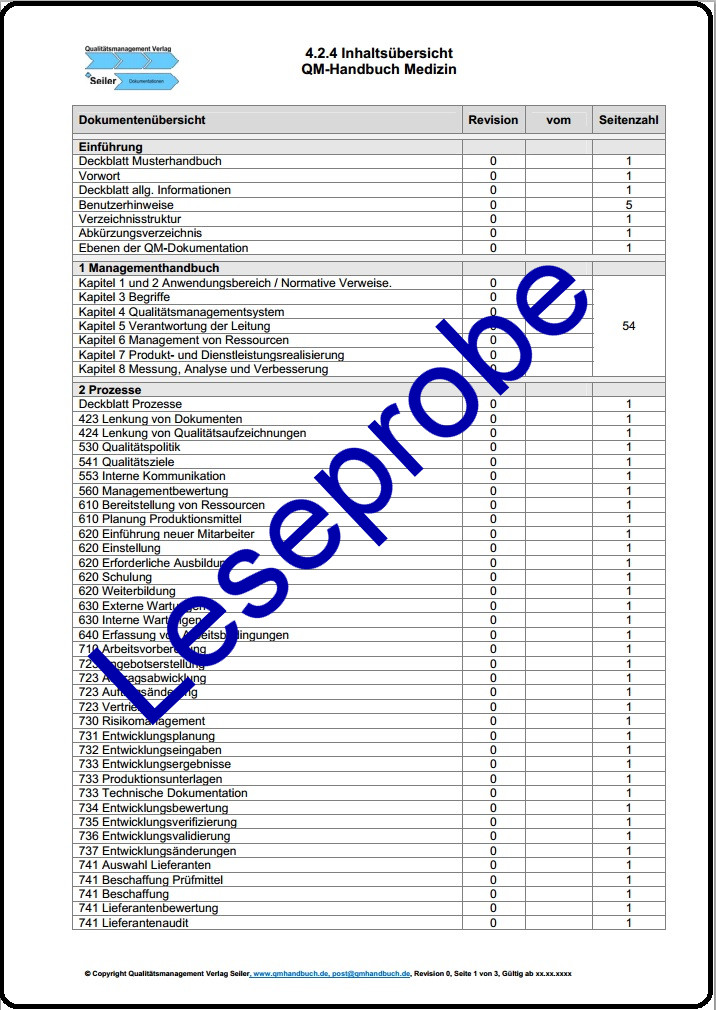
- Handbuch (8 Kapitel & Entsprechungstabelle zur MDR),
- Prozessvorlagen (88),
- Arbeitsanweisungen (14),
- Formblätter / Nachweisvorlagen (82),
- Zusatz ISO 9001 (6),
Die Nummerierung entspricht der zugrundeliegenden Norm. So kann eine Zuordnung zur Norm leicht realisiert werden.
Die Anforderungen der MDR sind an den entsprechenden Stellen eingefügt. Zusätzlich gibt es eine Arbeitsanweisung zur Umsetzung der MDR 2017/745.
Unterschied zur Vorgängerversion:
- Erweiterung zur DIN EN ISO 13485:2021,
- Begründungen zur MDR 2017/745,
- Umsetzungstabelle zur MDR / ISO 13485,
- Zusatz zur ISO 9001,
Konditionen:
- Keine Ergänzungslieferungen,
- Bezahlung per Rechnung oder PayPal,
- Lieferung per Download oder manuell,
Verwandte Produkte:
Besonderes:
Alle Disziplinen wie Entwicklung, Produktion, Instandhaltung, Installation, Vertrieb und Dienstleistung sind beachtet.
Die MDR hat viele Anforderungen an das QM-System. Diese sind im Handbuch umfassend integriert.
Wir haben die Formblätter und Nachweisformen mit Beispielen gefüllt. Alle Beispielinhalte sind mit "rot" gekennzeichnet. Die Struktur des Handbuchs richtet sich nach der Norm. Das bedeutet, dass alle Dokumente nach dem entsprechenden Normpunkt nummeriert sind.
Der Aufwand zur Anpassung des Musterhandbuches unter Beachtung von MS-Office Kenntnissen ist gering. Für Unternehmen mit bestehender Zertifizierung, dient das Handbuch dazu das bestehende System zu optimieren und MDR konform zu gestalten.
ISBN bei Bestellung über den Buchhandel 978-3-947669-13-4 |
Downloads:
Kein Abo und keine kostenpflichtigen Ergänzungslieferungen!
 |
Alle Vorlagen können in MS-Office Programmen bearbeitet werden. |
|

